Pilhas
Toda pilha é um dispositivo em que ocorre uma reação espontânea de oxidorredução que gera corrente elétrica, que, por sua vez, é aproveitada para fazer algum equipamento funcionar.
Esses dispositivos receberam esse nome porque a primeira pilha a ser criada foi inventada por Alessandro Volta, no ano de 1800, e era formada por discos de zinco e cobre separados por um algodão embebido em salmoura. Tal conjunto era colocado de forma intercalada, um em cima do outro, empilhando os discos e formando uma grande coluna. Como era uma pilha de discos, começou a ser chamada por esse nome.

As pilhas são sempre formadas por dois eletrodos e um eletrólito. O eletrodo positivo é chamado de cátodo e é onde ocorre a reação de redução. Já o eletrodo negativo é o ânodo e é onde ocorre a reação de oxidação. O eletrólito é também chamado de ponte salina e é a solução condutora de íons.
Para você entender como isso gera corrente elétrica, veja o caso de uma das primeiras pilhas, a pilha de Daniell, em que havia um recipiente com uma solução de sulfato de cobre (CuSO4(aq)) e, mergulhada nessa solução, estava uma placa de cobre. Em outro recipiente separado, havia uma solução de sulfato de zinco (ZnSO4(aq)) e uma placa de zinco mergulhada. As duas soluções foram ligadas por uma ponte salina, que era um tubo de vidro com uma solução de sulfato de potássio (K2SO4(aq)) com lã de vidro nas extremidades. Por fim, as duas placas foram interligados por um circuito externo, com uma lâmpada, cujo acendimento indicaria a passagem de corrente elétrica:
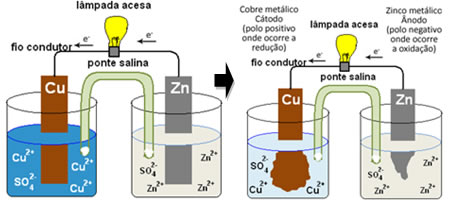
O que acontece é que o zinco tem maior tendência de se oxidar, isto é, de perder elétrons, por isso, o zinco metálico da lâmina funciona como o eletrodo negativo, o ânodo, onde ocorre a oxidação: Zn( s) ↔ Zn2+(aq) + 2 e-. Os elétrons perdidos pelo zinco são transportado pelo circuito externo até o cobre, gerando a corrente elétrica que liga a lâmpada. Os íons cobre da solução recebem os elétrons (reduzem-se) e transformam-se em cobre metálico que se deposita sobre a lâmina de cobre. Isso significa que esse é o eletrodo positivo, cátodo, onde ocorre a redução: Cu2+(aq) + 2 e- ↔ Cu( s).
As pilhas atuais possuem esse mesmo princípio de funcionamento, em que um metal doa elétrons para outro, por meio de uma solução condutora, e é produzida a corrente elétrica. A diferença é que as pilhas usadas hoje são secas, porque não utilizam como eletrólito uma solução líquida, como ocorre na pilha de Daniell.
Hoje existe uma diversidade muito grande de pilhas que são vendidas comercialmente. Entre elas as mais comuns são as pilhas ácidas (de Leclanché) e as pilhas alcalinas.
Ambas possuem o zinco como o eletrodo negativo; já como polo positivo, há uma barra de grafita instalada no meio da pilha envolvida por dióxido de manganês (MnO2), carvão em pó (C) e por uma pasta úmida. A diferença é que, na pilha ácida, usa-se na pasta úmida o cloreto de amônio (NH4Cl) e cloreto de zinco (ZnCl2) – sais de caráter ácido – além de água (H2O). Já na pilha alcalina, usa-se o hidróxido de potássio (NaOH), que é uma base.
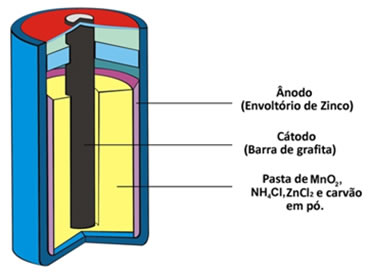
As pilhas de Leclanché são mais indicadas para equipamentos que requerem descargas leves e contínuas, como controle remoto, relógio de parede, rádio portátil e brinquedos. Já as pilhas alcalinas dispõem de 50 a 100% a mais de energia que uma pilha comum do mesmo tamanho, sendo indicadas para equipamentos que exigem descargas rápidas e mais intensas, tais como rádios, tocadores de CD/DVD, MP3 portáteis, lanternas, câmeras fotográficas digitais etc.

Saiba mais sobre quais são os eletrólitos e eletrodos usados nessas e em outros tipos de pilhas, bem como para que tipos de equipamentos elas são mais recomendadas, lendo os artigos relacionados mais abaixo



